Instrukcja pomiaru pH — teoria laboratoryjnych zastosowań pH
Przewodnik po teorii pH przedstawia jasny i praktyczny opis pomiaru pH w laboratorium i w terenie. Podano w nim wiele porad i wskazówek dotyczących ważnych punktów, a pełny opis pomiaru jest wsparty teoretycznym opisem pomiaru kwasowości i zasadowości. Sporo uwagi poświęcono także różnym rodzajom dostępnych elektrod pH oraz kryteriom wyboru elektrody
dla konkretnej próbki.
Podgląd Przewodnika po teorii pH:
1. Wprowadzenie do teorii pH
Dlaczego używane na co dzień ciecze, takie jak ocet, zaliczamy do cieczy kwaśnych? Wynika to z faktu, że ocet zawiera nadmiar jonów hydroniowych (H3O+), który stanowi o kwasowym charakterze roztworu. Z kolei nadmiar jonów hydroksylowych (OH–) w danym produkcie sprawia, że ma on charakter zasadowy albo alkaiczny. W czystej wodzie jony hydroniowe są równoważone przez jony hydroksylowe, a o takim roztworze mówimy, że ma neutralną wartość pH.
H3O+ + OH– ↔ 2 H2O
Woda tworzy się w reakcji kwasu i zasady. Jeśli cząsteczki substancji wskutek dysocjacji wydzielają jony lub protony wodorowe, substancję taką nazywamy kwasem, a roztwór staje się kwaśny. Do najbardziej znanych kwasów należą kwas solny, kwas siarkowy i kwas octowy albo ocet. Poniżej przedstawiono dysocjację octu:
CH3COOH + H2O ↔ CH3COO– + H3O+
Kwasy mają różną moc. O poziomie kwasowości decyduje łączna liczba jonów wodoru w roztworze. Wartość pH definiuje się wówczas jako ujemny logarytm stężenia jonów wodoru. (Ściśle mówiąc, decyduje o niej aktywność jonów wodoru. Aby uzyskać dodatkowe informacje na temat aktywności jonów wodorowych, patrz rozdział 4.2).
pH = –log [H3O+]
Różnicę ilościową między substancjami kwaśnymi i zasadowymi można określić przez wykonanie pomiarów wartości pH. Na rys. 4 podano kilka przykładów wartości pH powszechnie stosowanych substancji i środków chemicznych:
... dowiedz się więcej z Przewodnika po teorii pH ....
1.1. Kwaśny czy zasadowy
1.2. Dlaczego wartości pH podlegają pomiarom?
1.3. Narzędzia do pomiaru pH
a) Elektroda pH
b) Elektrody referencyjne
c) Elektrody kombinowane
1.4. Praktyczne instrukcje prawidłowego pomiaru pH
a) Przygotowanie próbki
b) Kalibracja
c) Elektroda pH
d) Oczekiwana dokładność pomiaru
1.5 Instrukcje pomiaru pH krok po kroku
2. Wybór i obsługa elektrody.
Aby wykonać optymalne pomiary pH, należy wybrać najpierw właściwą elektrodę.
Najważniejsze kryteria próbek, jakie należy wziąć pod uwagę: skład chemiczny, jednorodność, temperatura, zakres pH oraz wielkość pojemnika (ograniczenia długości i szerokości). Wybór zyskuje na znaczeniu w przypadku próbek bezwodnych, o niskiej przewodności, dużej zawartości białka i wysokiej lepkości, ponieważ w tym przypadku szklane elektrody ogólnego zastosowania są narażone na rozmaite błędy.
Czas reakcji i dokładność elektrody zależą od kilku czynników. Pomiary wykonywane w skrajnych wartościach pH i temperaturach albo przy niskiej przewodności mogą zająć więcej czasu niż pomiary roztworów wodnych w temperaturze pokojowej i o neutralnym odczynie pH.
Znaczenie różnego rodzaju próbek wyjaśniono poniżej przez przyjęcie różnych właściwości elektrody jako punktu wyjściowego. W rozdziale tym omawiamy głównie elektrody kombinowane.
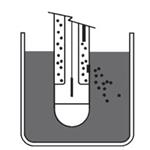
a) Złącza ceramiczne
Otwór umieszczony w części referencyjnej elektrody pH zapewnia utrzymanie kontaktu z próbką może mieć kilka form. Formy te wykształciły się z biegiem czasu ze względu na różne wymagania stawiane elektrodom przy pomiarze zróżnicowanych próbek. Najprostszym rodzajem złącza jest „złącze standardowe"
znane jako złącze ceramiczne. Składa się z porowatego elementu ceramicznego, który jest umieszczony wewnątrz szklanego korpusu elektrody. Porowaty materiał ceramiczny pozwala na powolny wypływ elektrolitu z elektrody, ale nie dopuszcza do swobodnego wylewu.
Ten rodzaj złącza doskonale nadaje się do standardowych pomiarów w roztworach wodnych; Przykładem takiej elektrody jest METTLER TOLEDO InLab®Routine Pro. Schemat zasady działania tego złącza pokazano na rysunku obok.
.. dowiedz się więcej z Przewodnika po teorii pH ....
2.1. Różne rodzaje złączy
a) Złącza ceramiczne
b) Złącza tulejowe / złącza z polerowanego szkła
c) Złącza otwarte
2.2. Systemy referencyjne i elektrolity
2.3. Typy szkła membranowego i kształtów membrany
2.4. Elektrody pH do konkretnych zastosowań
Łatwe próbki
Brudne próbki
Emulsje
Próbki półstałe i stałe
Próbki płaskie i bardzo małe próbki
Małe próbki i pojemniki na trudne próbki
InLab®Power (Pro)
2.5. Konserwacja elektrody
2.6. Przechowywanie elektrod
Przechowywanie krótkoterminowe
Przechowywanie długoterminowe
Czujniki temperatury
2.7. Czyszczenie elektrody
Zatkanie siarczkiem srebra (Ag2S)
Zatkanie chlorkiem srebra (AgCl)
Zatkanie białkami
Inne przypadki zatkania złącza
2.8. Regeneracja i czas eksploatacji elektrody
2.9. Informacje dodatkowe
3.Rozwiązywanie problemów podczas pomiarów pH
Problemy, które powstają podczas pomiarów pH, mogą mieć różne przyczyny: od miernika, kabla i elektrody po roztwory buforowe, temperaturę pomiaru i próbkę (aplikacja), Szczególną uwagę należy zwrócić na symptomy problemu, gdyż pomagają one zlokalizować źródło wady. W poniższej tabeli przedstawiono opis symptomów i przyczyn:
Zbyt wysokie lub zbyt niskie odczyty lub odczyty poza skalą „---"
- Sprawdź miernik, kabel, elektrodę, procedurę kalibracji i temperaturę próbki
Wartość się nie zmienia
- Sprawdź miernik, kabel i elektrodę
Krótki czas reakcji
- Sprawdź elektrodę i próbkę/aplikację
Duże przesunięcie po kalibracji
- Sprawdź elektrodę, roztwory buforowe i procedurę kalibracji
Małe nachylenie po kalibracji
- Sprawdź elektrodę, roztwory buforowe i procedurę kalibracji
Błąd kalibracji
- Sprawdź, miernik, kabel, elektrodę, roztwory buforowe i procedurę kalibracji
Wartości dryftu pomiaru
- Sprawdź elektrodę i próbkę/aplikację
... dowiedz się więcej z Przewodnika po teorii pH ....
3.1. Kontrola miernika i kabla
3.2. Kontrola temperatury próbki i aplikacji
3.3. Kontrola buforów i procedury kalibracji
Kilka porad na temat stosowania buforów
3.4. Sprawdzenie elektrody
4. Kompleksowa teoria pH
4.1. Definicja wartości pH
Sørenson definiuje pH jako ujemny logarytm stężenia jonu H3O+:
pH = –log [H3O+]
Z tego równania widać, że koncentracja jonu H3O+ zmienia się co dziesięć jednostek, natomiast wartość pH zmienia po jednej jednostce. To znakomicie ilustruje, jak ważna jest możliwość pomiaru nawet małych zmian wartości pH próbki.
Teorię pH opisuje się często za pomocą jonów H+ w połączeniu z wartościami pH, chociaż właściwym wyznacznikiem jest jon hydroniowy (według oficjalnej nomenklatury IUPAC: jon oksoniowy (H3O+):
H+ + H2O ↔ H3O+
Właściwości dysocjacyjne skutkujące powstawaniem jonów hydroniowych i hydroksylowych wykazują nie tylko kwasy i zasady, ale także czysta woda:
2 H2O ↔ H3O+ + OH–
... dowiedz się więcej z Przewodnika po teorii pH ....
4.1. Definicja wartości pH
4.2. Korelacja między stężeniem i aktywnością
4.3. Roztwory buforowe
Pojemność buforowa (ß)
Wartość rozcieńczenia (ΔpH)
Efekt temperatury (ΔpH/ΔT)
4.4. Łańcuch pomiaru w konfiguracji pomiaru pH
elektroda pH
Elektroda referencyjna
4.5. Kalibracja/adiustacja konfiguracji pomiaru pH
4.6. Wpływ temperatury na pomiary pH
Oddziaływanie temperatury na elektrodę
Skrzyżowanie izotermiczne
Inne zjawiska termiczne
Oddziaływanie temperatury na mierzoną próbkę
4.7. Zjawiska w przypadku pomiarów specjalnych
Błąd zasadowy
Błąd kwasowy
Reakcje z elektrolitem referencyjnym
Czynniki organiczne
Odwiedź stronę METTLER TOLEDO i pobierz bezpłatny przewodnik.
- Autor:
- METTLER TOLEDO
- Dodał:
- Mettler-Toledo Sp. z o. o.
Czytaj także
-

Czujnik specjalny do wiarygodnych pomiarów pH sera
Pomiar pH sera przy pomocy tradycyjnych czujników posiadających ceramiczne złącze może być kłopotliwy. Ser ma stałą konsystencję oraz zawiera...
-

Profesjonalna analiza wody - dlaczego jest ważna? Kto powinien zlecić?
Woda ma nieodpowiedni smak lub zapach? A może pozostawia po sobie osady? Jeśli chcesz wiedzieć, z czego wynikają takie problemy, koniecznie...
-

-

-

-

-

-